新华网北京12月20日电(杨玉云) 近日,记者随国家药监局走基层采访组来到上海浦东新区,看到国家药监局药品审评检查长三角分中心(以下简称药品长三角分中心)和医疗器械技术审评检查长三角分中心(以下简称器械长三角分中心)的接待大厅里坐满了人,他们是从上海、江苏、浙江和安徽赶来的医药和医疗器械企业的法规和技术人员,正在向分中心工作人员咨询有关产品注册及上市前的各种专业及法规要求。

长三角分中心与企业面对面沟通
药品和器械长三角分中心成立于2020年12月22日,是党中央、国务院在长三角区域推进更高起点深化改革和更高层次对外开放战略部署的重要一环,也是国家药监局贯彻落实长三角区域发展规划的重要举措,主要服务于长三角区域医药器械产业发展,探索国家药品器械监管改革创新模式。
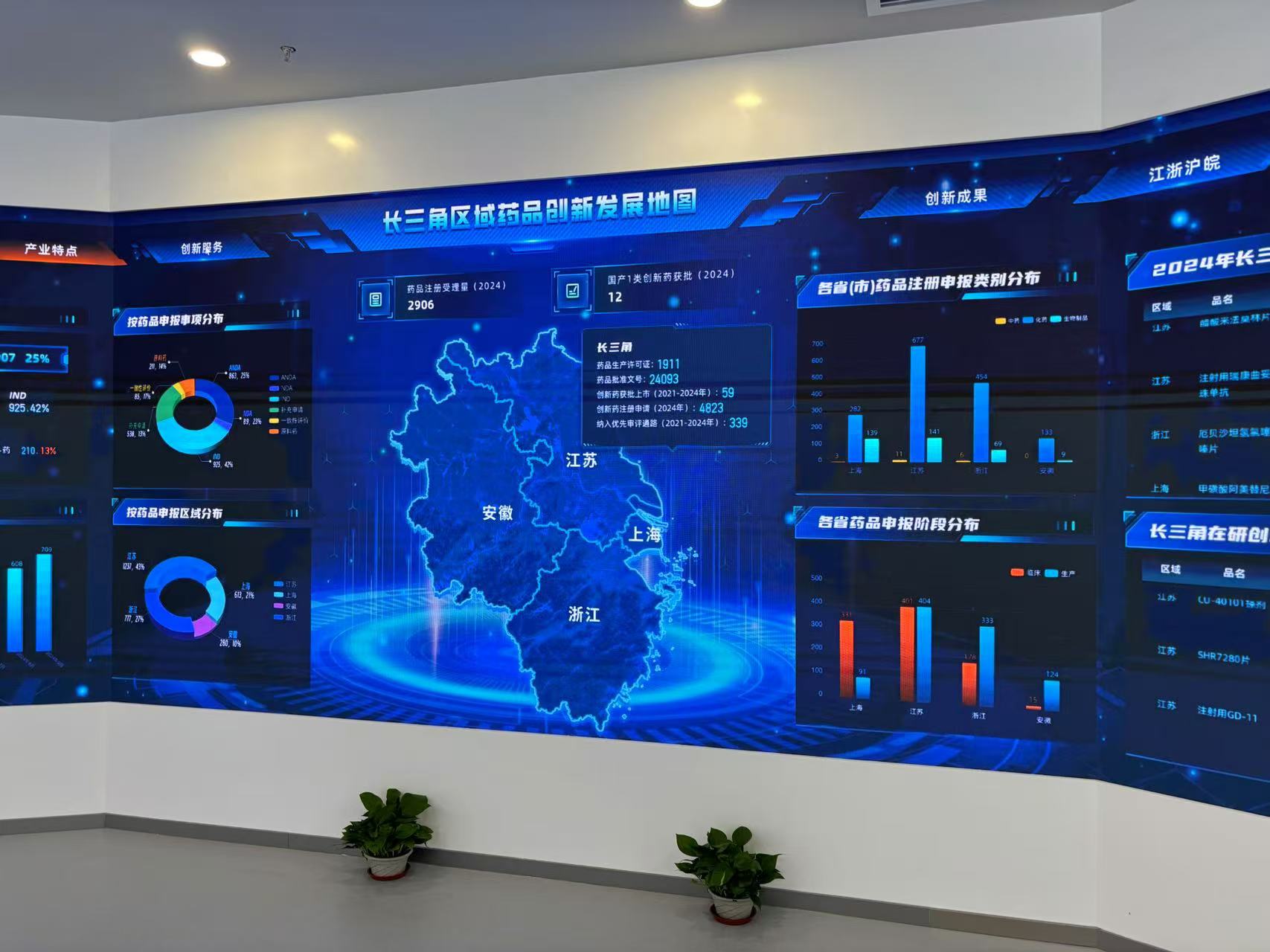
截至目前,药品分中心已完成专业审评任务7701件。今年共完成专业审评任务4599件,比去年同期增长48%。2024年,药品分中心注册受理服务窗口,实现了区域受理业务100%全覆盖。截至11月30日,已承接区域受理申请5760件,约占全国国产受理总量的25.3%。
值得关注的是,区域内新药临床试验申请申报量特别突出,约占全国50%,充分体现了“长三角研发”的雄厚实力。随着审评覆盖率和审评能力的不断提升,越来越多的企业主动加强与分中心进行沟通交流,分中心作为国家药品审评重要支撑力量的作用不断显现,已累计开展沟通交流、面对面咨询等现场服务2147家次,解答问题13000余件。
而器械长三角分中心自2021年5月正式开展业务工作以来,各项业务工作也取得明显成效。截至2024年11月底,器械长三角分中心累计受理各类申请事项19000余件,其中仅2024年前11个月,即受理各类申请事项近8000件,较去年同期增长超50%。
数字是抽象的,两个分中心成立后到底提供了什么服务,解决了哪些实际问题?企业的回答最具说服力。
上海联影医疗科技股份有限公司法规注册部刘建霞说,联影医疗每年都会有不少新的产品研发和注册。在产品研发和注册阶段,对于一些新功能的内部验证或临床评价,公司内部可能都会有不同的理解。以前,公司的注册、研发人员都要经常出差去北京进行受理前咨询,或者只能在线上和审评员进行沟通。不但成本高,而且很费时间。而现在在上海就可以得到器械长三角分中心最为专业和高效的指导。
她还介绍,联影医疗2023年上市的一款PET/CT新产品,在产品研发过程中,企业内部法规和临床人员对于临床评价路径有着不一样的看法,后来通过线上预约,顺利申请了器械长三角分中心的受理前咨询,很快就得到和分中心审评员面对面咨询和沟通的机会,经过审评员的专业答复,最终确定了临床评价路径,后来整个产品的注册发补过程在临床评价方面的问题也比其它产品少了很多,整个注册过程较为顺利,注册周期比同类产品缩短了2个多月。目前这款产品已经在国内多家临床试验机构完成装机,给广大患者带来了福音。
近日,常州凯尼特医疗科技有限公司总经理李真给器械长三角分中心送来了一面锦旗,凯尼特的一款新产品——颅内取栓支架,就是在分中心完成的上市前各项沟通辅导工作。
李真说,在产品研发过程中,“受理前技术咨询”这个环节解决了他们的很多疑问,也提醒了一些未曾识别到的风险,使公司的验证工作做的更加充分,为后期的注册审评节约了时间,大大提高了效率。
在产品上市注册过程中,器械长三角分中心的补正意见中也具有较强的建设性及参考性,这对补充产品验证及完善资料起到了很大的作用,对于补正意见中疑问及不理解之处,企业也通过咨询答疑的方式,获得了分中心专业性的指导。
李真特别赞扬器械长三角分中心的审评效率。如三类医疗器械,目前国家规定补正前技术审评期限是90个工作日,补正后技术审评期限是60个工作日,但实际上分中心都能在规定内尽可能缩短时限,提前给到企业答复。分中心的审评效率之高,大大推进了产品注册上市的进程,令人称赞。
北海康成(上海)生物科技有限公司是一家专注于罕见病领域的全球化生物制药公司,2024年9月,公司治疗成人和儿童I型和III型戈谢病酶替代疗法药物——CAN103,获得国家药监局药品审评中心优先审评资格,是国内首个自主研发酶替代疗法的药物。
北海康成相关负责人表示,早在MAH生物制品分段生产试点的讨论阶段,分中心就针对研发、生产和注册中可能存在的问题给予专业指导和建议。11月6日,在“面对面”受理靠前服务启动后,,北海康成获得了更具针对性的答复和指导,11月11日,公司正式提交了CAN103戈谢病的新药申请,当天下午,药品长三角中心就申报资料中的问题第一时间来电沟通,11月13日上午,该药即获正式受理。这一药品获批后,将是我国首个本土自主研发并进入临床应用的戈谢病酶替代疗法一类创新药,可完全替代同类进口产品。
2024年2月23日,科济药业控股有限公司自主研发的全人抗自体BCMA CAR-T产品——赛恺泽®(泽沃基奥仑赛注射液)正式在中国获批上市,用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。泽沃基奥仑赛是国内上市的第五款CAR-T细胞产品,同时也是第二款靶向BCMA的CAR-T产品。
这一产品就是在药品长三角中心全程辅导下成功上市的。药品分中心自2021年8月开始对科济药业的泽沃基奥仑赛注射液开展靠前指导服务,对研发申报中遇到的程序问题和专业技术问题进行耐心细致解答。
多家药械企业在接受采访时也表示,药品、器械两个长三角分中心举办的各种专题培训越来越多,针对性越来越强,对企业越来越具有指导价值,通过这些培训,企业相关人员的知识面和专业性得到了很大提升,提高了企业各类产品、尤其是创新产品少走弯路,不走错路,最快进行受理与审批,极大缩短了产品上市时间。





